Les
piles - généralité |
Les piles transforment de l'énergie
chimique en énergie électrique.
Les piles du type saline ou alcaline sont les piles habituelles pour poste
de radio, jouet, lampe de poches, etc.
Les piles au mercure, argent ou au lithium sont les piles type
"boutons", pour caméra, appareils de. photo, agenda électronique,...
le type (norme IEC) d'une pile est inscrit sur la pile ( par exemple 3R12,
6 LR61)
nombre d'éléments
1, 2, 6
|
indication (éventuelle)
sur l'électrochimie
L,M,S,B,C,E,G,U, P
|
forme de l'élément
R, F, S
|
dimensions de la pile
cylindriques ou bouton
|
modifiez la première ligne des cases !
la norme ANSI donne : R03 => AAA; R1 =>N; R6 =>AA; R8
=>A; R12=>B;R14=>C; R20=>D;R22=>C; R25=>F;R26=>G;R27=>J;R40=>6.
construction des piles salines ou alcalines
Les piles sont construites avec 2 électrodes nommées pôle positif et
pôle négatif, plongées dans un électrolyte.
Dans la pile saline, le boîtier en zinc représente le pôle négatif. Au
centre de ce boîtier se trouve le pôle positif (charbon) qui est entouré par un
dépolarisant (bioxyde de manganèse) et qui baigne dans l'électrolyte (chlorure
d'ammonium).
Les matériaux utilisés dépendent du type
de pile.
 |
Chaque élément d'une pile alcaline, fournit une tension
de (environs et si neuve) 1,5 V.
Pour augmenter la tension d'une pile, le constructeur place plusieurs
éléments en série.
par exemple : une pile 9 [V] est constituée de 6 éléments de 1,5
[V] branché en série.
Une 4,5 V est composée de 3 éléments en série. |

|
Couplage des piles:
Le couplage parallèle est fortement déconseillé car un courant de
décharge peut s'établir entre les piles si elles n'ont pas exactement la même tension U.
Toutefois si on le fait on constate ceci:
U = U1 =
U2 = ...= Un [V]
Q =Q1 + Q2
+...+Qn [C]
Le couplage série est utilisé pour augmenter la tension utile. Toutefois
on n'augmente pas la durée d'utilisation :
U = U1 +
U2 + ...+ Un [V]
Q =Q1 = Q2
=...= Qn [C]
note : Q exprime la quantité d'électricité en coulomb. Un coulomb
représente 1 [As] (1 ampère pendant 1 seconde). Pour les piles et les accumulateurs il
est d'usage d'employer un multiple de l' As soit Ah . 1 Ah = 3600 As.
Cette unité est utilisée par les praticiens qui vont jusqu'à parler
de mAh (milli-Ah) alors qu'ils ne parlent pas de kC !!
|
|
les
types de piles:(excepté les piles à combustible) |
Fonctionnement des piles salines ou
alcalines:
Dans la pile se produit des réactions chimiques qui produisent une
différence de potentiel entre ses deux pôles. Si l'on ferme le circuit extérieur, un
courant circule du - au + à l'intérieur de la pile (du charbon au zinc). Par
électrolyse, il se produit du chlorure de zinc et de l'ammoniac qui se dissolvent dans le
chlorure d'ammonium (électrolyte). En même temps, de petites bulles d'hydrogène se
collent à la surface du pôle positif et forme une couche électriquement isolante. On
dit que la pile se polarise.
Au repos, le bioxyde de manganèse libère son oxygène qui se combine
avec l'hydrogène pour former de l'eau . La résistance diminue, la pile se dépolarise.
La tension U à vide augmente.
Toutefois le dépolarisant s'épuise de manière irréversible.
| caractéristiques des piles: La pile
présente une tension à vide U [V] environs égale à 1,5 [V] pour une pile
neuve. Cette tension diminue en cours d'utilisation selon une courbe qui varie selon le
type de pile. Après une période de repos, cette tension "remonte" un peu, ceci
est dû à la dépolarisation (diminution de la résistance interne, suite à une
réaction chimique autours du pôle positif).
La capacité d'une pile dépend de ses dimensions. Elle peut atteindre
quelques dizaines d'heures. |
Capacité des piles (source Duracell) (voir d'autres exemples)
| norme IEC |
norme ANSI |
C [mAh] |
| LR03 |
AAA |
1175 |
| LR06 |
AA |
2250 |
| LR14 |
C |
7000 |
| LR20 |
D |
15000 |
| 6F22 |
9 V |
550 |
|
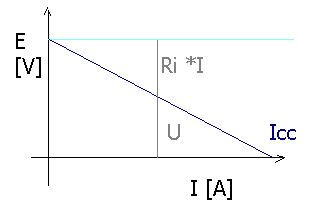
La tension à ses bornes U [V] dépend de la
tension à vide (parois notée E) et de la chute de tension interne (donc du
courant débité et de la résistance interne Ri):
U = E - Ri I
Ci contre, on constate que pour n'importe quelle valeur de courant, E
= U + Ri I .
Si U = 0 [V], alors nous avons un courant de court-circuit.
Si U = E alors I = 0 [A].
Avec 2 mesures, on peut tracer la caractéristique U = f(I)
de la pile et déterminer ses E et Ri . |
|
|
électrode + |
électrolyte |
électrode - |
E [V] |
énergie [Wh/kg] |
présentation
exemple |
saline |
bioxyde de manganèse et carbone |
chlorure d'ammonium et de zinc |
Zinc (bac) |
1,5 |
75 |
ronde/ rectangle.
R 14; R6 |
alcaline |
bioxyde de manganèse et carbone |
potasse |
poudre de Zinc |
1,5 |
125 |
ronde / rectangle.
LR61 |
mercure |
oxyde de mercure et carbone |
potasse |
poudre de Zinc |
1,35 |
175 |
bouton |
argent |
oxyde d'argent et carbone |
potasse |
poudre de Zinc |
1,55 |
225 |
bouton |
lithium |
bioxyde de soufre ou chlorure de
thionyle ou bioxyde de manganèse et carbone |
sel de lithium |
lithium |
1,5; 3 ou 3,6 |
325 |
bouton
CR 2032 (3V) |
note : les piles ne sont pas rechargeables. Il existe un
système pour pouvoir les régénérer environs 25 fois mais seuls les accumulateurs sont
rechargeables, quand aux piles à combustible,
une fois le combustible "utilisé", il faut en remettre, ce n'est donc pas une
recharge (inversion des processus chimiques).
tableau comparatif des capacités en [mAh]
| |
|
PR 41 |
70 |
SR 41 |
38 |
| LR 43 |
65 |
|
|
SR 43 |
120 |
| LR 44 |
95 |
PR 44 |
400 |
SR 44 |
130 |
| |
|
PR 48 |
170 |
SR 48 |
75 |
| LR 54 |
38 |
|
|
SR 54 |
70 |
| LR 55 |
20 |
|
|
SR 55 |
35 |
| |
|
|
|
SR 58 |
18 |
| |
|
|
|
SR 59 |
24 |
| |
|
|
|
SR 60 |
15 |
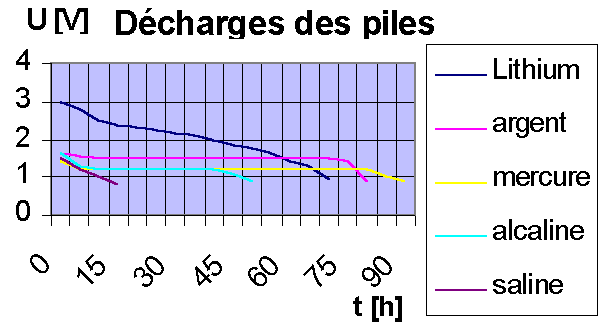
Tableau comparatif de décharge des piles
|
|
Les
piles à combustible |
Ce type de piles est certainement La
Pile du futur. Tant pour l'alimentation de voitures électriques, que pour des
villas ou usine que pour de petits appareils (natel, ordinateur portable,etc..).
Actuellement la NASA utilise des piles de ce genre.
La recherche pour des véhicules avance. Toutefois le prix est encore
(1999) trop élevé : env. 20 000 Frs / kW - et une voiture a besoin d'environs 50 kW.
Des unités de 11 MW ont déjà été testée de 1991 à 1997. La durée
de fonctionnement (vie) est seulement de 23 000 heures. Plus de 120 piles entre 50 et 500
kW ont été installées au Japon.
Une pile à combustible de 20W (env. 25 frs) permettrai 30 heures de
communication... Une pile avec un 0,5 dm3 de graphite alimenterait plus d'un
mois un ordinateur portable (20W).
fonctionnement.
Pour fonctionner, cette pile a besoin de deux éléments :
l'hydrogène et l'oxygène et elle rejette de l'eau . Si la pile
ne fonctionne plus, il suffit de lui redonner du combustible : l'hydrogène (elle peut
prendre elle-même l'oxygène de l'air).
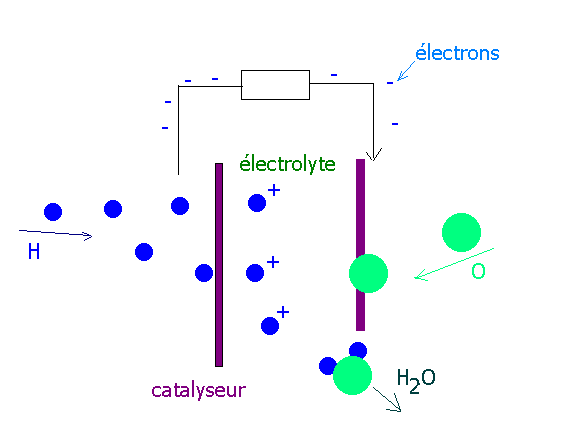
| Le principe de fonctionnement est simple. Sur l'anode l'hydrogène; sur la
cathode de l'oxygène Le catalyseur est souvent à base de platine.
Entre les deux pôles, il y a un électrolyte (membrane échangeuse de protons) qui
laisse passer les ions positif de l'hydrogène . Il y a oxydation de l'hydrogène et donc
formation d'eau sur la cathode.
Les électrons eux ne peuvent pas traverser l'électrolyte et doivent donc prendre un
autre chemin (circuit externe). Cela permet donc à un courant électrique de s'établir
de la cathode à l'anode. |
 |
La tension obtenue par un élément de pile à combustible
est d'environs 1V. Pour augmenter la tension utile, on place des éléments en série.
C'est à dire que l'anode d'une pile est séparée de la cathode de la pile adjacente par
une cloison étanche qui permet la liaison électrique et qui est équipée de
distributeurs pour l'oxygène et l'hydrogène (et éventuellement des canaux pour un
liquide de refroidissement).
Le combustible pose toutefois un problème. Son volume est trop important
sous forme gazeuse. Pour l'avoir à l'état liquide on perd 40 % de son énergie et
l'hydrogène liquide s'évapore trop rapidement. Pour miniaturiser la pile, on utilise
d'autres matériaux qui contiennent de l'hydrogène: décaline (C10H18),
borhydrure de lithium, hydrure métallique solide, méthanol, hydrogène dans nanofibres
de graphite, carbonate.
Les différents types de piles sont:
- à acide phosphorique (the best à ce jour, pour piles de plus
de 100 kW, mais cher 25000frs/kW),
- à carbonate fondu (fonctionne à plus de 650 degrés, sans
catalyseur coûteux)
- à oxyde solide (fonctionne à plus de 650 degrés, sans catalyseur
coûteux),
- à membrane échangeuse de protons ( pour des petites puissances, ne
laisse passer que les ions chargés positivement)
- à combustible alcaline ( navette spatiale, récupération de l'eau
possible, bon rendement)
La température de la réaction varie beaucoup selon les procédés
utilisés pour atteindre 800 degrés dans un pile à oxyde solide de 10 kW. La chaleur
dans ce cas est réutilisée pour le chauffage de l'immeuble.
|
|
L'accumulateur: |
| L'accumulateur est un appareil qui converti de l'énergie
chimique et énergie électrique et réciproquement. En effet si les
piles habituelles ont une décharge
irréversible et les piles à combustibles
ont besoin d'un "plein d'hydrogène" pour continuer de fonctionner,
l'accumulateur lui se recharge avec de l'énergie électrique.
| |
électrode nég |
électrolyte |
électrode pos. |
Une cuve isolante contenant un électrolyte - un
acide dilué (par exemple pour une batterie au plomb :acide sulfurique + de l'eau : H2SO4
+ H2O) contient deux électrodes (p.e. : en plomb Pb). dont les surfaces vont
chimiquement se combiner avec l'électrolyte ( p.e. les deux plaques se transforment en
sulfate de plomb : PbSO4 ). A ce stade, il n'y a pas de différence de
potentiel entre elles. |
PbSO4 |
2H2O
faible densité |
PbSO4 |
Lors de la charge, en raccorde une électrode au pôle
positif et l'autre au pôle négatif de la source de tension continue. Un courant peut
s'établir créant une électrolyse. Les plaques se modifient chimiquement (la positive
devient un bioxyde de plomb - PbO2 - et la négative du plomb pur- Pb).
L'électrolyte voit sa quantité d'acide sulfurique augmenter et sa densité
augmente. A la fin de la charge, on mesure une tension d'environs 2 V entre les deux
électrodes. |
PbO2 |
2H2SO4
grande densité |
Pb |
Lors de la décharge ( raccordement d'un récepteur
sur les électrodes) un courant électrique s'établit. Il est de sens contraire à celui
de la charge. Les transformations chimiques seront également inverse: les deux
électrodes se retransforment en sulfate de plomb. La densité de l'électrolyte diminue. |
PbSO4 |
H2O
faible densité |
PbSO4 |
|
|
Les
piles à l'eau de mer |
| Inventée vers 1970 les piles à l'eau de mer se
développent réellement seulement depuis 1990.
Elles sont composées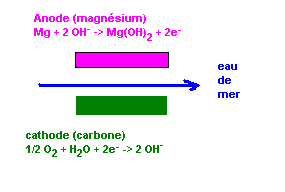
- d'une anode métallique ( magnésium ou aluminium) et
- d'une cathode formée d'un manteau interne du cuivre ou des fibres de carbone.
Fonctionnement:
L'oxygène contenu dans l'eau de mer sert d'oxydant et permet l'électrolyse ( l'eau de
mer est donc l'électrolyte). L'eau de mer est corrosive et enlève l'oxyde de magnésium
qui sui s'accumule lors de la réaction électrochimique et évite une augmentation de la
résistance interne de la pile.
Un dépôts de calcaire se forme généralement sur la cathode et diminue ainsi le
rendement de la pile.
Utilisation
Cette pile équipe déjà un robots sous-marin et lui fourni l'énergie utile à sa
propulsion. Pour fonctionner elle a besoin d'un débit de 200 dm3 par seconde.
|
|
L'accumulateur
au plomb: |
fonctionnement
voir ci-dessus
Attention, il est bon de savoir que la capacité diminue si la température.
faites variez la température de -20 à + 25 degrés centigrade.
Ceci est utile lorsque vous démarrer votre véhicule. Plus la température est basse,
moins votre batterie est chargée, moins de fois vous pourrez essayer de le faire
démarrer.
construction :
 L'accumulateur
au plomb (type batterie de voiture ) est un couplage électrique "série" de
plaques alternativement positives et négatives. Ces plaques peuvent être formées de
tubes ou de grilles remplis de plomb pur spongieux ( plaques négatives - sur la photo, il
s'agit de plaques à grilles) et de bioxyde de plomb (plaques positives). Les plaques sont
posées dans une cuve contenant l'électrolyte. Les plaques ne touchent pas le fond de la
cuve pour éviter qu'elles soient en court-circuit lorsque les déchets s'y accumulent. L'accumulateur
au plomb (type batterie de voiture ) est un couplage électrique "série" de
plaques alternativement positives et négatives. Ces plaques peuvent être formées de
tubes ou de grilles remplis de plomb pur spongieux ( plaques négatives - sur la photo, il
s'agit de plaques à grilles) et de bioxyde de plomb (plaques positives). Les plaques sont
posées dans une cuve contenant l'électrolyte. Les plaques ne touchent pas le fond de la
cuve pour éviter qu'elles soient en court-circuit lorsque les déchets s'y accumulent.
Le tension de l'accumulateur ne dépend pas des dimensions de ses plaques qui n'ont
d'importance que pour sa capacité Q [Ah; C]
entretient :
Actuellement les batteries de voitures ne demande plus d'entretien.
Les autres types de batteries doivent régulièrement subir des charges et décharges
totales (sinon elles se sulfatent) . La charge de la batterie peut être contrôlée en
mesurant la densité de l'électrolyte ( mesure en degrés baumé).
La durée de charge devrait se faire en 10 heures. Ce qui implique une valeur du
courant de charge égale au dixième de la capacité de l'accumulateur ( Q= 60 Ah => I
= 6 A).
La fin de la charge se constate par l'apparition de bulles (d'hydrogène et d'oxygène)
dans.l'électrolyte.
Lors de la manipulation d'un accumulateur, il faut veiller à ne pas court-circuiter
ses bornes. Sa résistance interne est très faible et permet donc un très grand courant
de court-circuit nuisible à la durée de vie de l'accumulateur et de l'objet ayant servit
à créer le court-circuit...
|
|
Accumulateurs
alcalins : |
| Il existe plusieurs types d'accumulateur alcalins . Par
exemple : fer-nickel, cadmium-nickel...
Ces accumulateurs ont pour défaut de s'autodécharger. Leur nombre de charges est
limité ( env. 200 à 500)
Dans le cas d'accumulateurs aux formats de piles (cadmium-nickel) la tension maximale
est à peine de 1,3 [V]. Ce qui les rend inutilisables pour certains appareils à piles
salines ou alcalines. Leur capacité est d'environs 900 [C] (250 [mAh]).
| |
accumulateur chargé |
accumulateur déchargé |
| pôle positif + |
pôle négatif - |
pôle positif + |
pôle négatif - |
| cadmium - nickel |
hydroxyde de nickel
Ni(OH)3 |
cadmium
Cd |
hydroxyde de nickel
Ni(OH)2 |
hydroxyde de cadmium
Cd(OH)3 |
| fer - nickel |
hydroxyde de nickel
Ni(OH)3 |
fer
Fe |
hydroxyde de nickel
Ni(OH)2 |
hydroxyde de fer
Fe(OH)2 |
|
|
Sources diverses: |
| Piézo-électricité |
Électrostatique |
Thermocouple |
Solaire -
Photovoltaïque |
fonctionnement :
La pression mécanique sur un quartz provoque l'apparition d'une tension à ses
bords. |
fonctionnement :
Par friction, un corps peut "prendre" des électrons à un second. Il a donc
une différence de potentiel.
(quelques kV-> 102 kV) |
fonctionnement :
On produit une tension lorsqu'on chauffe au point de soudure deux métaux différents
(quelques mV) |
fonctionnement :
Lorsque des photons atteignent la matière semi conductrice, une tension apparaît.
environs (20V) |
utilisation :
microphones, briquets |
utilisation :
tube cathodique (TV)
foudre |
utilisation :
mesure de température
convertisseur AC->DC (appareil de mesure) |
utilisation :
panneaux solaires
(projet solaire-éolienne) |
|
|
L'alternateur
: |
|
Pour produire de l'énergie électrique alternative, on emploie des
alternateurs.
La construction de l'alternateur est identique à celle du moteur synchrone.
Le principe est de faire tourner le rotor de cette machine (souvent
entraîné par des turbines ou
des moteurs diesel). Le rotor doit produire un flux magnétique constant. Il est produit
soit avec un aimant permanent, soit le rotor est bobiné et alimenté en tension continue,
donc parcouru par un courant continu (souvent fourni par une dynamo placée en bout
d'arbre) pour produire un flux magnétique fixe par rapport au rotor. Toutefois comme le
rotor tourne, le flux tourne à la même vitesse.
Ce flux magnétique induit des tensions dans les enroulements statoriques.
Ces tensions sont de formes sinusoïdales. Pour les machines triphasées, les enroulements
et donc les tensions sont décalées de 120 degrés.
La fréquence est déterminée par la relation suivante :
f = n * p [s-1]
|
f : fréquence en [[Hz]
n: vitesse de rotation du rotor en [1/s] (tours/seconde)
p: nombre de paire de pôle |
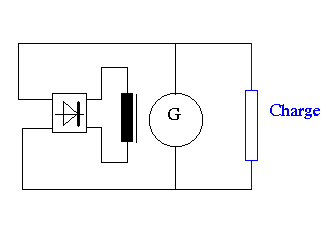
Ci contre un exemple d'un alternateur monophasé.
la partie centrale (G) représente les enroulements statoriques qui sont
le siège des tensions induites alternative.
La cellule redresseur ( en pont Greatz) sert à alimenter en courant
continu l'enroulement du rotor. Ici le rotor (produit l'excitation magnétique) est placé
en parallèle, il s'agit donc d'une excitation en dérivation.
L'alimentation du rotor se fait par deux bagues.
Le principal inconvénient de ce type de machine est qu'à la mise en
fonction, il est indispensable d'avoir une aimantation rémanente du rotor, sinon il faut
un dispositif auxiliaire d'amorçage.
Le second inconvénient est qu'une chute de tension de l'alternateur
implique une diminution du courant d'excitation et donc une nouvelle diminution de la
tension induite... Pour palier à ce genre de phénomène, le constructeur peut placer
quelques spires de l'inducteur "en série" avec l'induit . Le courant qui a
provoqué une chute de tension est d'une valeur supérieur à la valeur nominale ce qui
permettra d'augmenter le flux inducteur et d'éviter la réaction en chaîne décrite plus
haut.
|
|
|